Hauptinhalt
Barrett-Ösophagus / -Karzinom
Das Forschungsnetzwerk g4b (genes for barrett‘s) beschäftigt sich mit der Aufklärung der genetischen und zellbiologischen Ursachen des Barrett-Ösophagus und -Karzinoms. Die molekulargenetischen Analysen von g4b werden am Zentrum für Humangenetik des Universitätsklinikums Marburg sowie am Institut für Humangenetik des Universitätsklinikums Bonn durchgeführt. Zur Webpage von g4b gelangen sie unter www.barrett-konsortium.de.
Klinik des Barrett-Ösophagus und -Karzinoms
Der Barrett-Ösophagus entsteht zumeist als Folge einer Reflux-Erkrankung, bei der die Magensäure in die Speiseröhre (Ösophagus) zurückfließt. Etwa 10% aller Patienten mit einer Reflux-Ösophagitis, d. h. mit einer Entzündung der unteren Speiseröhre infolge einer Reflux-Erkrankung, entwickeln einen Barrett-Ösophagus (Böhmer et al. (2017) Neurogastroenterol Motil). Dabei kommt es zu typischen Veränderungen der Schleimhaut des Ösophagus, die nach dem Britischen Chirurgen Norman Barrett (1903-1979) als Barrett-Ösophagus bezeichnet werden. Symptome können Sodbrennen und Schmerzen im Brustbereich sein. Die Diagnose des Barrett-Ösophagus kann nur durch eine Speiseröhrenspiegelung (Endoskopie) erfolgen. Hierbei wird auch eine Gewebeprobe (Biopsie) entnommen, die die definitive Diagnose eines Barrett-Ösophagus ermöglicht.
Bei dem Barrett-Karzinom handelt es sich um Speiseröhrenkrebs, d. h. es befinden sich entartete Zellen (Krebszellen) in der Speiseröhre. Die Erkrankung entwickelt sich aus einem Barrett-Ösophagus, wobei nur ein kleiner Teil von Patienten mit einem Barrett-Ösophagus ein Barrett-Karzinom entwickelt (Böhmer et al. (2017) Neurogastroenterol Motil). Allerdings ist die Prävalenz des Barrett-Karzinoms in hochentwickelten Ländern in den letzten Jahren exponentiell angestiegen, woran maßgeblich Umweltfaktoren beteiligt sein werden. Es sind aber auch genetische Faktoren an der Entwicklung eines Barrett-Karzinoms beteiligt. Die Beschwerden des Barrett-Karzinoms treten oft erst im fortgeschrittenen Stadium auf. Erste Symptome sind Schluckbeschwerden, Schmerzen hinter dem Brustbein und Gewichtsverlust. Nach wie vor hat das Barrett-Karzinom im fortgeschrittenen Stadium eine schlechte Prognose. Ebenso wie beim Barrett-Ösophagus wird seine Diagnose in der Regel im Rahmen einer Endoskopie anhand einer Biopsie gestellt. Die anschließende mikroskopische Untersuchung der Gewebeproben durch einen erfahrenen Pathologen gibt dann Aufschluss, ob es sich tatsächlich um ein Barrett-Karzinom handelt.
Genetik des Barrett-Ösophagus und -Karzinoms
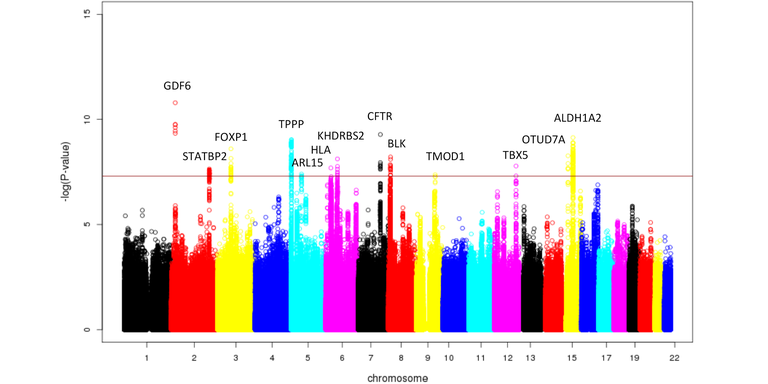
Beim Barrett-Ösophagus und -Karzinom handelt es sich um eine multifaktorielle Erkrankung (Böhmer et al. (2017) Neurogastroenterol Motil). Mit dem Ziel, genetische Risikovarianten für den Barrett-Ösophagus und das Barrett-Karzinom zu identifizieren, führten wir gemeinsam mit Forschergruppen aus Australien, Großbritannien und den USA eine GWAS an einem großen Fall-Kontrollkollektiv europäischer Herkunft durch (> 10.000 Patienten, > 17.000 Kontrollen) (Gharahkhani et al. (2016) Lancet Oncol). In dem Kollektiv testeten wir > 11 Millionen häufige genetische Varianten auf Assoziation zur Krankheit. Insgesamt konnten wir 13 genetische Risikovarianten identifizieren (P < 5 x 10-08, Odds Ratio (OR) = 1,11-1,23), die dem Barrett-Ösophagus und -Karzinom ursächlich zugrunde liegen. Dem Manhattan Plot in Abbildung 1 sind die assoziierten Risikovarianten, deren chromosomale Lokalisationen und die in der Nähe zu den Varianten liegenden Gene zu entnehmen.
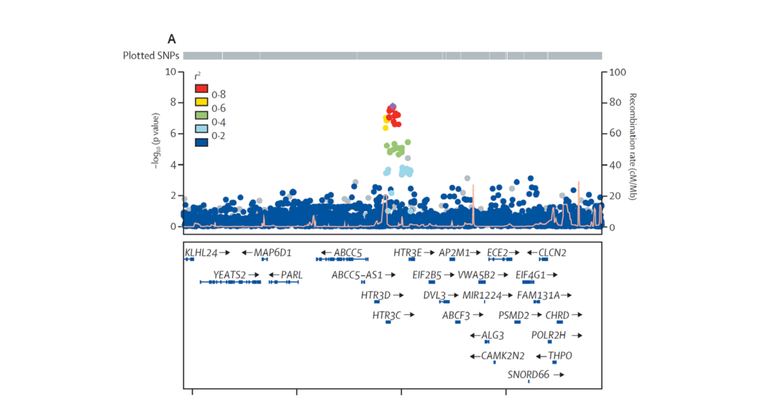
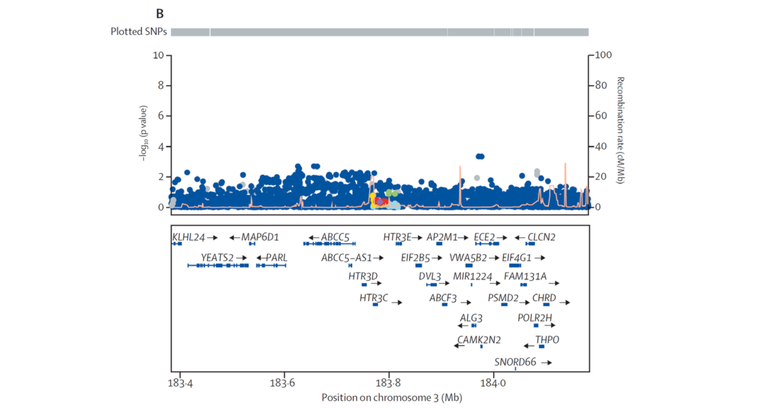
Alle signifikant assoziierten Risikovarianten liegen gleichsam der Entwicklung eines Barrett-Ösophagus und -Karzinoms ursächlich zugrunde. Eine Ausnahme hiervon ist die genetische Variante rs9823696 auf Chromosom 3q27 nahe der Gene HTR3C und ABCC5. Sie zeigt ausschließlich in der GWAS zum Barrett-Karzinom Assoziation (P = 1,6 x 10-08, OR = 1,17). Demgegenüber ist sie nicht mit dem Barrett-Ösophagus assoziiert (P = 0,45, OR = 1,02) (s. Abbildung 2). Solchen Karzinom-spezifischen Risikovarianten wird große Bedeutung zukommen. Sie werden nämlich die Wahrscheinlichkeit vorhersagen können, dass Patienten mit Barrett-Ösophagus ein Karzinom entwickeln.
Abbildung 2: Regionaler Assoziationsplot für den Barrett-Karzinom-spezifischen Assoziationsbefund nahe der Gene HTR3C und ABCC5. Jeder Punkt entspricht einer genetischen Variante. Ihre Lokalisation auf Chromosom 3q27 ist auf der X-Achse und die Stärke ihrer Krankheitsassoziation auf der Y-Achse abgebildet. Der obere Plot zeigte die genomweit-signifikante Assoziation zum Barrett-Karzinom (P < 5 x 10-08). Der untere Plot zeigt die gleiche Region ohne Assoziation zum Barrett-Ösophagus.
Die GWAS-Daten wurden auch Pathway-Analysen zugeführt. Sie zeigten, dass Gene im Bereich der Assoziationssignale für zelluläre Prozesse der Muskelzelldifferenzierung und mesenchymalen Zelldifferenzierung angereichert sind. Störungen der Muskeldifferenzierung könnten der Ausbildung von Zwerchfellhernien ursächlich zugrunde liegen, die ein maßgeblicher Dispositionsfaktor für Reflux von Magensäure in die Speiseröhre sind. Demgegenüber handelt es sich bei der mesenchymalen Zelldifferenzierung um einen wichtigen Pathway, der am Verlust der Zelladhäsion, verstärkten Zellmigration und Zellinvasion beteiligt ist. Es handelt sich um wichtige Vorgänge bei der Entstehung eines Barrett-Karzinoms (Gharahkhani et al. (2016) Lancet Oncol).
Gegenwärtig beschäftigt sich die Arbeitsgruppe mit der funktionellen Charakterisierung der identifizierten Risikovarianten. Zudem wird der gemeinsame genetische Einfluss zwischen dem Barrett-Ösophagus/-Karzinom und anderen Phänotypen, u. a. der Adipositas, auf der Ebene von Polygenic Risk Scores (PRSs) bestimmt und das Patienten-Kollektiv für erweiterte GWAS vergrößert.
Ansprechpartner
Prof. Dr. Johannes Schumacher
Zur Webpage von g4b gelangen sie unter www.barrett-konsortium.de.
Ausgewählte Publikationen
Ong JS, Dixon-Suen SC, Han X, An J; Esophageal Cancer Consortium; 23 and Me Research Team, Liyanage U, Dusingize JC, Schumacher J, Gockel I, Böhmer A, Jankowski J, Palles C, O'Mara T, Spurdle A, Law MH, Iles MM, Pharoah P, Berchuck A, Zheng W, Thrift AP, Olsen C, Neale RE, Gharahkhani P, Webb PM, MacGregor S. A comprehensive re-assessment of the association between vitamin D and cancer susceptibility using Mendelian randomization. Nat Commun. 2021 Jan 11;12(1):246.
Dighe SG, Chen J, Yan L, He Q, Gharahkhani P, Onstad L, Levine DM, Palles C, Ye W, Gammon MD, Iyer PG, Anderson LA, Liu G, Wu AH, Dai JY, Chow WH, Risch HA, Lagergren J, Shaheen NJ, Bernstein L, Corley DA, Prenen H, deCaestecker J, MacDonald D, Moayyedi P, Barr H, Love SB, Chegwidden L, Attwood S, Watson P, Harrison R, Ott K, Moebus S, Venerito M, Lang H, Mayershofer R, Knapp M, Veits L, Gerges C, Weismüller J, Gockel I, Vashist Y, Nöthen MM, Izbicki JR, Manner H, Neuhaus H, Rösch T, Böhmer AC, Hölscher AH, Anders M, Pech O, Schumacher B, Schmidt C, Schmidt T, Noder T, Lorenz D, Vieth M, May A, Hess T, Kreuser N, Becker J, Ell C, Ambrosone CB, Moysich KB, MacGregor S, Tomlinson I, Whiteman DC, Jankowski J, Schumacher J, Vaughan TL, Madeleine MM, Hardie LJ, Buas MF. Germline variation in the insulin-like growth factor pathway and risk of Barrett's esophagus and esophageal adenocarcinoma. Carcinogenesis. 2020 Dec 10:bgaa132.
Dong J, Maj C, Tsavachidis S, Ostrom QT, Gharahkhani P, Anderson LA, Wu AH, Ye W, Bernstein L, Borisov O, Schröder J, Chow WH, Gammon MD, Liu G, Caldas C, Pharoah PD, Risch HA, May A, Gerges C, Anders M, Venerito M, Schmidt T, Izbicki JR, Hölscher AH, Schumacher B, Vashist Y, Neuhaus H, Rösch T, Knapp M, Krawitz P, Böhmer A, Iyer PG, Reid BJ, Lagergren J, Shaheen NJ, Corley DA, Gockel I, Fitzgerald RC; Stomach and Oesophageal Cancer Study (SOCS) consortium, Cook MB, Whiteman DC, Vaughan TL, Schumacher J, Thrift AP. Sex-Specific Genetic Associations for Barrett's Esophagus and Esophageal Adenocarcinoma. Gastroenterology. 2020 Dec;159(6):2065-2076.e1.
Böhmer AC, Hecker J, Schröder J, Gharahkhani P, May A, Gerges C, Anders M, Becker J, Hess T, Kreuser N, Thieme R, Noder T, Venerito M, Veits L, Schmidt T, Fuchs C, Izbicki JR, Hölscher AH, Dietrich A, Moulla Y, Lyros O, Lang H, Lorenz D, Schumacher B, Mayershofer R, Vashist Y, Ott K, Vieth M, Weismüller J, Moebus S, Knapp M, Neuhaus H, Rösch T, Ell C, Nöthen MM, Whiteman DC, Tomlinson I, Jankowski J, Fitzgerald RC, Palles C, Vaughan TL, Gockel I, Thrift AP, Fier H, Schumacher J. Shared Genetic Etiology of Obesity-Related Traits and Barrett's Esophagus/Adenocarcinoma: Insights from Genome-Wide Association Studies. Cancer Epidemiol Biomarkers Prev. 2020 Feb;29(2):427-433.
Schröder J, Schüller V, May A, Gerges C, Anders M, Becker J, Hess T, Kreuser N, Thieme R, Ludwig KU, Noder T, Venerito M, Veits L, Schmidt T, Fuchs C, Izbicki JR, Hölscher AH, Dakkak D, Jansen-Winkeln B, Moulla Y, Lyros O, Niebisch S, Mehdorn M, Lang H, Lorenz D, Schumacher B, Mayershofer R, Vashist Y, Ott K, Vieth M, Weismüller J, Mangold E, Nöthen MM, Moebus S, Knapp M, Neuhaus H, Rösch T, Ell C, Gockel I, Schumacher J, Böhmer AC. Identification of loci of functional relevance to Barrett's esophagus and esophageal adenocarcinoma: Cross- referencing of expression quantitative trait loci data from disease-relevant tissues with genetic association data. PLoS One. 2019 Dec 31;14(12):e0227072.
An J, Gharahkhani P, Law MH, Ong JS, Han X, Olsen CM, Neale RE, Lai J, Vaughan TL, Böhmer AC, Jankowski J, Fitzgerald RC, Schumacher J, Palles C, BEACON, 23andMe Research Team, Whiteman DC, MacGregor S. Gastroesophageal reflux GWAS identifies risk loci that also associate with subsequent severe esophageal diseases. Nat Commun. 2019 Sep 16;10(1):4219.
Böhmer AC, Schumacher J. Insights into the genetics of gastroesophageal reflux disease (GERD) and GERD-related disorders. Neurogastroenterol Motil 2017 29.
Gharahkhani P, Fitzgerald RC, Vaughan TL, Palles C, Gockel I, Tomlinson I, Buas MF, May A, Gerges C, Anders M, Becker J, Kreuser N, Noder T, Venerito M, Veits L, Schmidt T, Manner H, Schmidt C, Hess T, Böhmer AC, Izbicki JR, Hölscher AH, Lang H, Lorenz D, Schumacher B, Hackelsberger A, Mayershofer R, Pech O, Vashist Y, Ott K, Vieth M, Weismüller J, Nöthen MM; Barrett's and Esophageal Adenocarcinoma Consortium (BEACON); Esophageal Adenocarcinoma GenEtics Consortium (EAGLE); Wellcome Trust Case Control Consortium 2 (WTCCC2), Attwood S, Barr H, Chegwidden L, de Caestecker J, Harrison R, Love SB, MacDonald D, Moayyedi P, Prenen H, Watson RGP, Iyer PG, Anderson LA, Bernstein L, Chow WH, Hardie LJ, Lagergren J, Liu G, Risch HA, Wu AH, Ye W, Bird NC, Shaheen NJ, Gammon MD, Corley DA, Caldas C, Moebus S, Knapp M, Peters WHM, Neuhaus H, Rösch T, Ell C, MacGregor S, Pharoah P, Whiteman DC, Jankowski J, Schumacher J. Genome-wide association studies in oesophageal adenocarcinoma and Barrett's oesophagus: a large-scale meta-analysis. Lancet Oncol 2016 17: 1363-73.
Becker J, May A, Gerges C, Anders M, Schmidt C, Veits L, Noder T, Mayershofer R, Kreuser N, Manner H, Venerito M, Hofer JH, Lyros O, Ahlbrand CJ, Arras M, Hofer S, Heinrichs SK, Weise K, Hess T, Böhmer AC, Kosiol N, Kiesslich R, Izbicki JR, Hölscher AH, Bollschweiler E, Malfertheiner P, Lang H, Moehler M, Lorenz D, Ott K, Schmidt T, Nöthen MM, Hackelsberger A, Schumacher B, Pech O, Vashist Y, Vieth M, Weismüller J, Knapp M, Neuhaus H, Rösch T, Ell C, Gockel I, Schumacher J. The Barrett-associated variants at GDF7 and TBX5 also increase esophageal adenocarcinoma risk. Cancer Med 2016 5: 888-91.
Becker J, May A, Gerges C, Anders M, Veits L, Weise K, Czamara D, Lyros O, Manner H, Terheggen G, Venerito M, Noder T, Mayershofer R, Hofer JH, Karch HW, Ahlbrand CJ, Arras M, Hofer S, Mangold E, Heilmann-Heimbach S, Heinrichs SK, Hess T, Kiesslich R, Izbicki JR, Hölscher AH, Bollschweiler E, Malfertheiner P, Lang H, Moehler M, Lorenz D, Müller-Myhsok B, Ott K, Schmidt T, Whiteman DC, Vaughan TL, Nöthen MM, Hackelsberger A, Schumacher B, Pech O, Vashist Y, Vieth M, Weismüller J, Neuhaus H, Rösch T, Ell C, Gockel I, Schumacher J. Supportive evidence for FOXP1, BARX1, and FOXF1 as genetic risk loci for the development of esophageal adenocarcinoma. Cancer Med 2015 4: 1700-4.