Hauptinhalt
Kurzdarstellung unserer Forschungsschwerpunkte – Abteilung Bogdan
Die Gestaltbildung und Erhaltung von Geweben und Organen erfordern dynamische Veränderungen und Anpassungen der Zellform und der Zellmotilität. Die Untersuchung des Zytoskeletts und der beteiligten Moleküle, Signalproteinkomplexe sowie regulatorischen Mechanismen sind daher wesentlich für ein tiefgreifendes Verständnis der molekularen Zellbiologie von Geweben und Organen und der Pathologie menschlicher Erkrankungen wie Infektionen, akute und chronische Entzündungen, Immunerkrankungen und maladaptive Remodellingprozesse. Zur Untersuchung dieser Prozesse verbinden wir in unseren experimentellen Strategien die Physiologie gleichermaßen mit der Drosophila Genetik, der Zellbiologie. sowie hochauflösende, bildgebende Techniken (3D-SIM, 4D-SDM, LSM, Light-Sheet Mikroskopie) und Einzel-Zell RNA-Analysen.
Weiterführende Informationen und Kontakt finden Sie auf den Seiten des Instituts für Physiologie und Pathophysiologie.
Folgende Module der AG Bogdan sind Teil der Studiengänge Humanbiologie BSc. und MSc.:

Inhalt ausklappen Inhalt einklappen A. Analyse der molekularen Mechanismen und Akteure bei der kalziumabhängigen epidermalen Wundheilung
Epithelien sind zusammenhängende Schichten polarisierter Zellen, die selektive Barrieren bilden, die die meisten unserer Organe, einschließlich der Epidermis unserer Haut, auskleiden. Bei einer Verletzung muss das Epithelgewebe den verletzten Bereich schnell verschließen und umgestalten, um Infektionen vorzubeugen und die Gewebehomöostase und Gewebefunktion aufrechtzuerhalten. Drosophila hat sich als wertvolles genetisches Modellsystem für die Untersuchung der Wundheilung eines einfachen Epithels bei Gewebeschäden erwiesen. Kalzium ist ein bekannter allgegenwärtiger sekundärer Botenstoff und das erste „Schadenssignal“ nach zellulärer und multizellulärer Verletzung. Es ist jedoch noch unklar, wie wundinduzierte Kalziumsignale initiiert werden und wie Kalzium den schnellen epithelialen Wundverschluss sowie Immunreaktionen in vivo fördert. Frühere Studien deuteten darauf hin, dass mechanisch gesteuerte Kalziumkanäle den Kalziumeinstrom initiieren könnten, während nachgeschaltete, auf Kalzium reagierende Effektorproteine wie EF-Hand-enthaltende Zytoskellet-Proteine wie Swip-1 das Schadenssignal in morphologische Veränderungen umwandeln, die durch die Reorganisation des Aktin-Zytoskeletts angetrieben werden. Wir werden unser kürzlich etabliertes Drosophila Einzelzell-Wundmodellsystem verwenden, um hochauflösende Lebendzellmikroskopie und Genetik zu kombinieren, um diese Hypothese zu testen und die konservierten molekularen Ereignisse und Akteure zu definieren, die den epidermalen Wundverschluss vorantreiben, und wie Immunzellen zur Wundheilung beitragen. Insbesondere werden wir die konservierten Gene identifizieren und charakterisieren, die für die Initiierung und Ausbreitung von Kalziumwellen in verletztem Epidermisgewebe erforderlich sind. Zweitens werden wir die Gene identifizieren und charakterisieren, die für kalziumregulierte Effektorproteine kodieren, die Veränderungen in der Zellmorphologie, Motilität und Immunzellreaktionen vorantreiben. Und schließlich werden wir die Rolle von Immunzellen in epidermalen Wunden funktionell analysieren.
Mehr zum Thema kann unter den Pressemitteilungen der Uni Marburg nachgelesen werden.Inhalt ausklappen Inhalt einklappen B. Untersuchung der molekularen Mechanismen der Dynamik und Plastizität von Immunzellen
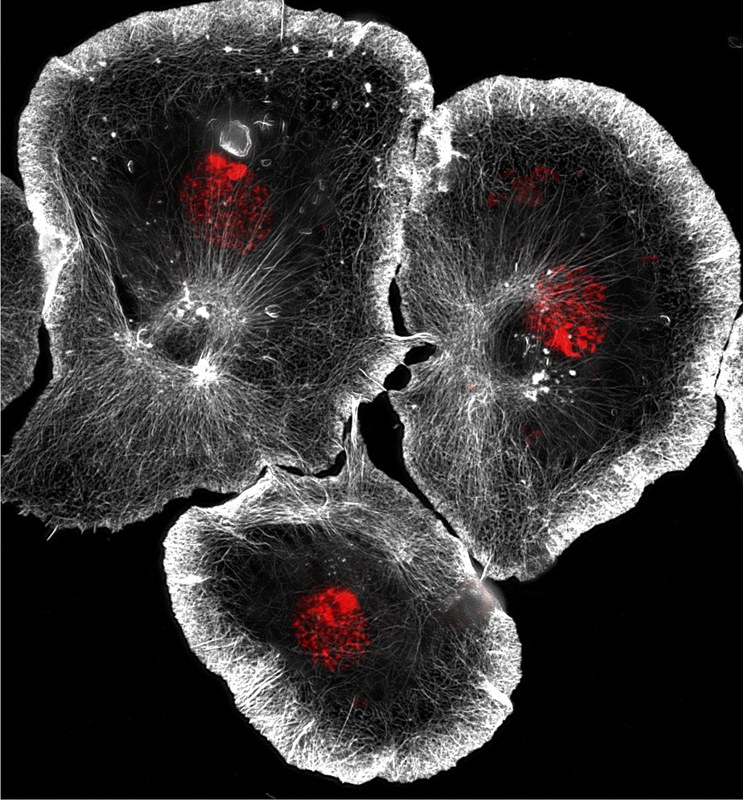
Das angeborene Immunsystem ist auf eine Vielzahl konservierter zellulärer und molekularer Strategien angewiesen, um die Abwehr von Krankheitserregern, den Gewebeumbau und die Reparatur zu vermitteln. Drosophila ist ein geeigneter genetischer Modellorganismus zur Untersuchung der Blutzellenentwicklung und der angeborenen Immunität. Ähnlich wie bei Säugetieren beruht die erste Verteidigungslinie gegen eindringende Krankheitserreger und Wunden bei Drosophila sowohl auf einer humoralen Reaktion, durch die Effektormoleküle wie antimikrobielle Peptide in die Hämolymphe sezerniert werden, als auch auf einer zellulären Reaktion, bei der Krankheitserreger von Blutzellen phagozytiert werden. insbesondere Makrophagen. Wir haben Drosophila Makrophagen als hervorragendes Modellsystem etabliert, das viele Vorteile kultivierter Zellen mit einem genetischen In-vivo-Modellsystem zur Untersuchung der konservierten Genfunktion bei der Einzelzellmigration und der Immunzellreaktion bei Verwundung kombiniert. Mithilfe verschiedener RNAi- und Überexpressionsansätze haben wir zuvor zahlreiche Zytoskelett- und Signalmoleküle identifiziert, die die Morphologie und Motilität von Immunzellen steuern.
Vor kurzem haben wir damit begonnen, Einzelzell-Transkriptomik und hochauflösende Mikroskopie zu kombinieren, um die Heterogenität und Plastizität von Drosophila Blutzellen weiter zu untersuchen. Wir identifizierten undifferenzierte und spezifizierte Hämozyten mit unterschiedlichen molekularen Signaturen, die mit unterschiedlichen Funktionen wie antimikrobieller, antimykotischer Immunabwehr, Zelladhäsion oder Sekretion verbunden sind. Unsere Daten stellen die erste molekulare Beschreibung der Blutzellen von Drosophila-Puppen dar und liefern erste Einblicke in die funktionelle Diversifizierung und Plastizität von Blutzellen während der Entwicklung.
Über dieses Projekt berichtete die Pressestelle der Uni Marburg am 06.05.2022. Der Bericht mit zusätzlichen Videos kann unter den Uni-Nachrichten nachgelesen werden.
PodcastInhalt ausklappen Inhalt einklappen C. Untersuchung des kalziumabhängigen Zellumbaus in der Herzphysiologie und -pathophysiologie
Herzerkrankungen sind weltweit immer noch die häufigste Todesursache. Das Herz reagiert auf pathologische Stresszustände wie Bluthochdruck oder Ischämie mit Myokardhypertrophie, Fibrose und Narbenbildung. Diese maladaptive Reaktion ist durch einen ausgeprägten Wundheilungs- und Umbauprozess gekennzeichnet, der zu einer veränderten physiologischen Funktion und der Entwicklung einer pathologischen Dysfunktion und Herzinsuffizienz führt. Auf zellulärer Ebene geht der Umbau des Herzens nicht nur mit einer veränderten Expression und Regulierung von Ionenkanälen und Transportern einher, die Arrhythmien verursachen, sondern auch mit dramatischen Veränderungen der Zellgröße und Zellform durch die Neuorganisation des Aktin-Zytoskeletts. Vergrößerte hypertrophe Kardiomyozyten unterliegen einer deutlichen Umwandlung von einer runden Zellform zu einer flachen und ausgebreiteten Morphologie mit charakteristischen Veränderungen in der Organisation der Sarkomerfilamente. Diese strukturellen Veränderungen sind zumindest teilweise kalziumabhängig. Die zugrunde liegenden molekularen Mechanismen, wie Kardiomyozyten ihre Zellform und ihr Verhalten neu organisieren, sind noch wenig verstanden. Um diese Mechanismen besser zu verstehen, haben wir begonnen, das Drosophila Herz als genetisches Modellsystem zu etablieren. In diesem Forschungsprojekt möchten wir in Kooperation mit anderen Arbeitsgruppen unterschiedliche Tiermodelle (Maus Ratte und Fliege) nutzen, um die konservierte Funktion von Kalzium-abhängigen Aktinregulatoren (z.B. Swip-1) in der Physiologie und Pathophysiologie des Herzens (cardiac remodelling and ageing) zu entschlüsseln. Unser Projekt zielt darauf ab, evolutionär alte Strategien der Wundheilung als potenzielle Schlüsselprozesse zur Auslösung kardialer Umbauprozesse zu identifizieren und dadurch neue potenzielle Behandlungsziele zu identifizieren.
Dieses Projekt wird durch die Behring-Röntgen-Stiftung gefördert.Inhalt ausklappen Inhalt einklappen D. Molekulare Mechanismen in der Kontrolle kollektiver, invasiver Zellmigration
Bei der invasiven, kollektiven Zellwanderung muss eine Gruppe von Zellen die Kraft aufbringen, um durch die ECM oder andere Zellen zu durchdringen. Das Drosophila Ovar ist ein hervorragendes Modelsystem zur Untersuchung der molekularen Grundlagen in die Zell-Zellkommunikation während der kollektiven Zellmigration und Zellinvasion. Im neunten Entwicklungsstadium löst sich eine Gruppe von 4-8 Follikelzellen aus dem anterioren Follikelepithelverband heraus (Delamination). Diese sogenannten Grenzzellen (border cells) migrieren als Zellcluster zwischen die Nährzellen hindurch nach posterior bis sie die Oozyte erreichen. Die Delamination und das invasive Migrationsverhalten der Grenzzellen dient als einfaches genetisch zugängliches in vivo Modell für die Metastasierung epithelialer Tumore, die konservierte Signaltransduktionskaskaden zugrunde liegen. So wird die Transformation der Follikelepithelzellen in invasive Zellen durch den JAK/STAT Signalweg vermittelt, der einen zentralen C/EBP Transkriptionsfaktor Slow border cells (Slbo) aktiviert. Ähnlich geht eine Aktivierung von JAK/STAT-Signaltransduktion sowie Induktion von C/EBP einher mit der Metastasierung zahlreicher Tumore beim Menschen.
Ein Video dazu finden Sie unten auf dieser Seite.