Hauptinhalt
AG Jacob
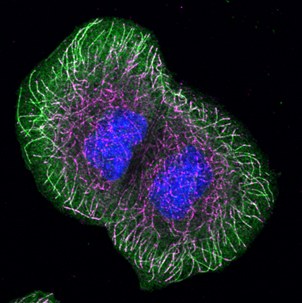
Membranen von Epithelzellen werden durch enge Verbindungen in einen apikalen Bereich, der dem Organlumen zugewandt ist, und einen basolateralen Bereich, der an benachbarte Zellen oder die Basalmembran angrenzt, getrennt. Beide Membrandomänen unterscheiden sich erheblich in ihrer Protein- und Lipidzusammensetzung. Der Transport neu synthetisierter apikaler Membranproteine verläuft nach dem Verlassen des Golgi-Apparates in Transportvesikeln, die über längere Passagen entlang von Mikrotubuli bewegt werden. Vor dem Erreichen der Zielmembran können verschiedene endosomale Kompartimente durchwandert werden.
Aktuelle Projekte in unserer Gruppe befassen sich mit den posttranslationalen Modifikationen der Mikrotubuli, die die Leitbahnen für den apikalen Proteintransport darstellen. Hier konnten wir zeigen, dass die Detyrosinierung am carboxyterminalen Ende von α-Tubulin beim apikalen Transport eine wichtige Rolle spielt. Wird die Tubulin-Tyrosin-Ligase, ein Enzym, das die Detyrosinierung rückgängig macht, entfernt, so wird die gesamte polare Organisation der Epithelzellen dramatisch verändert.
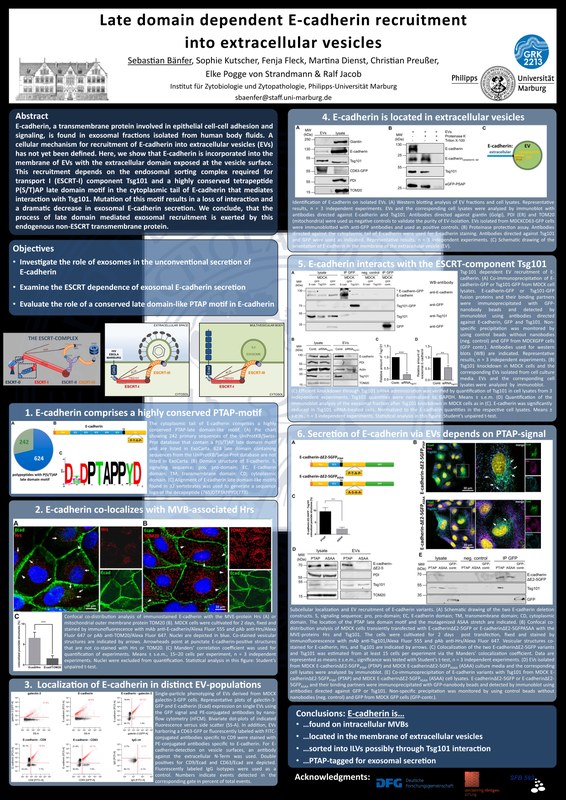
In einem weiteren Projekt studiert unsere Gruppe die nicht-klassische Sekretion von Galectin-3, einem Lektin, das als apikaler Sortierrezeptor fungiert und unabhängig von ER und Golgi-Apparat in das apikale Medium sekretiert wird. Wir konnten beweisen, dass Galectin-3 intrazellulär in Vesikel multivesikulärer Endosomen rekrutiert wird, die ihren Inhalt nach Fusion mit der apikalen Plasmamembran als extrazelluläre Vesikel (EVs) freisetzen. Galectin-3 befindet sich dann im EV-Lumen und kann so über Körperflüssigkeiten zu anderen Zellen transportiert werden. Voraussetzung für das Einschleusen von Galectin-3 in EVs ist seine Interaktion mit Komponenten des ESCRT-Komplexes. Die Interaktion beruht auf dem Vorhandensein einer Signalsequenz aus vier Aminosäuren, die auch andere Proteine wie E-Cadherin in EVs einschleust. Dieser Mechanismus ist somit für das Beladen von EVs mit unterschiedlichen Proteinen von zentraler Bedeutung.
Weitere Informationen und Kontakt finden Sie auf den Seiten des Instituts für Zytobiologie.